- 抑制劑
- 化合物庫
- 抗體
- 生物試劑
- qPCR
- 2x SYBR Green qPCR Master Mix
- 2x SYBR Green qPCR Master Mix(Low ROX)
- 2x SYBR Green qPCR Master Mix(High ROX)
- 蛋白實驗
- Protein A/G免疫沉淀磁珠
- Anti-DYKDDDDK Tag免疫磁珠
- Anti-DYKDDDDK Tag親和凝膠
- Anti-Myc免疫磁珠
- Anti-HA免疫磁珠
- 磁力架
- Poly DYKDDDDK Tag多肽
- 細胞核與細胞漿蛋白抽提試劑盒
- 免疫磁珠
- 蛋白酶抑制劑Cocktail
- 蛋白酶抑制劑Cocktail(DMSO儲液)
- 磷酸酶抑制劑Cocktail
- 新產品
- 聯(lián)系我們
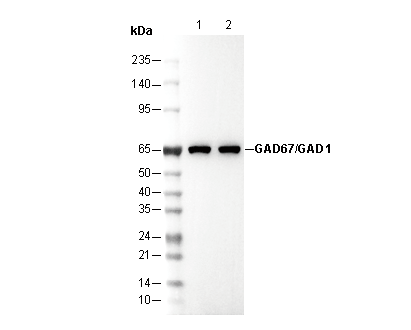
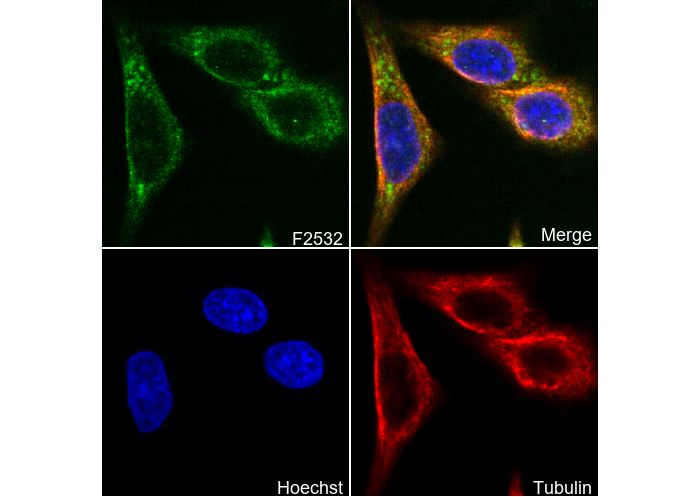
GAD67/GAD1 Antibody [H1N10]
目錄號: F2532
使用信息
| 稀釋比例 |
|---|
|
| 抗體應用 |
|---|
| WB, IHC, IF, FCM |
| 反應性 |
|---|
| Human, Mouse, Rat |
| 抗體類型 |
|---|
| Mouse Monoclonal Antibody |
| 儲存液配方 |
|---|
| PBS, pH 7.2+50% Glycerol+0.05% BSA+0.01% NaN? |
| 儲存條件(自收到貨起) |
|---|
| -20°C (avoid freeze-thaw cycles), 2 years |
|
預測分子量
|
|---|
|
66 kDa
|
| 陽性對照 | Human brain; Mouse cerebellum; Mouse pancreas; PC12 |
|---|---|
| 陰性對照 |
實驗方法
| WB |
|---|
實驗步驟: 樣品制備
1. 組織樣品:破碎組織,加入適量冰冷的 RIPA/NP-40 Lysis Buffer (含蛋白酶抑制劑Cocktail),低溫勻漿或置于冰上超聲裂解樣品,靜置30 min。 2. 貼壁細胞樣品:吸去培養(yǎng)基, 將細胞轉移至EP管中。用冰冷的 PBS 清洗細胞 2 遍。加入適量冰冷的 RIPA/NP-40 Lysis Buffer (含蛋白酶抑制劑Cocktail),超聲破碎,冰上靜置裂解 30 min。冰上靜置裂解 5 min。 3. 懸浮細胞樣品:將培養(yǎng)基轉移至離心管中離心,棄上清,用冰冷的 PBS 清洗細胞 2 遍。加入適量冰冷的 RIPA/NP-40 Lysis Buffer (含蛋白酶抑制劑Cocktail),冰上靜置裂解 5 min。 4. 將所得勻漿液/裂解液置于離心機中 4°C 離心 15 min,收集上清液;
5. 取少量裂解液測定蛋白質濃度;
6. 加入蛋白上樣緩沖液,將 20 µL樣品在 95~100°C加熱 5 min,冰上靜置冷卻后離心 5 min。
電泳分離
1. 根據所提蛋白的濃度,將適量蛋白樣品和 Marker 上樣至 SDS-PAGE 凝膠。建議分離膠(即下層膠)濃度:10 %。 SDS-PAGE 分離膠濃度選擇參照表 2. 電源調 80 V, 30 min。然后電源調 110 V~150 V,觀察 Marker,待蛋白所在的預染蛋白 Marker 指示帶得到合適的分離后,即可停止電泳。(注意電泳時電流切勿過大,如超過 150 mA 會導致溫度上升,容易影響跑膠結果。如無法避免采用大電流,可對電泳槽使用冰浴降溫。)
轉膜
1.拿出電轉槽,把夾子和耗材浸泡在預冷電轉液中;
2.用甲醇活化 PVDF 膜 1 min,用轉移緩沖液沖洗;
3.按照“夾子黑邊-海綿-濾紙-濾紙-膠-PVDF膜-濾紙-濾紙-海綿-夾子白邊”的順序安裝好; 4.將蛋白電轉移至 PVDF膜上。(推薦采用 0.45 µm PVDF 膜) PVDF 膜孔徑規(guī)格選擇參照表 濕轉法參考條件:200 mA, 120 min。
(注意電轉條件可根據蛋白大小適當調節(jié),分子量大的蛋白適宜采用大電流,并延長轉膜時間,但需要確保電轉槽始終處于低溫的環(huán)境中,避免凝膠融化。)
封閉
1. 電轉移后,室溫下用 TBST 洗膜 5 min;
2. 在封閉液中將膜孵育 1 h,室溫;
3. 用 TBST 洗膜 3 次,每次 5 min。
抗體孵育 1. 用 一抗稀釋液配制一抗工作液(建議一抗稀釋比 1:5000),4°C 條件下與膜輕柔搖晃孵育過夜; 2. 用 TBST 洗膜 3 次,每次 5 min;
3. 在封閉液中加入二抗,室溫條件下與膜輕柔搖晃孵育 1 h;
4. 孵育結束后,用 TBST 洗膜 3 次,每次 5 min。
顯色
1. 加入配制好的 ECL 發(fā)光底物(或根據二抗選擇其他顯色基質)混合均勻;
2. 與膜孵育1 min,去除多余底物(需保持膜濕潤),置于顯影儀中進行曝光。
|
| IHC |
|---|
實驗步驟:
脫蠟/補液
1. 脫蠟/水合切片:
2. 將切片在二甲苯中孵育 3 次,每次 5 分鐘。
3. 將切片在 100% 乙醇中孵育兩次,每次 10 分鐘。
4. 將切片在 95% 乙醇洗滌液中孵育兩次,每次 10 分鐘。
5. 用 dH2O 清洗切片兩次,每次 5 分鐘。
6.抗原修復:對于檸檬酸鹽:將載玻片浸入 1X 檸檬酸鹽暴露溶液中,在微波爐中加熱,直至開始沸騰; 在亞沸溫度 (95°-98°C) 下繼續(xù)煮 10 分鐘。 在工作臺上冷卻玻片 30 分鐘。
染色
1. 用 dH2O 清洗切片 3 次,每次 5 分鐘。
2. 將切片在 3% 過氧化氫中孵育 10 分鐘。
3. 用 dH2O 清洗切片兩次,每次 5 分鐘。
4. 在洗滌緩沖液中洗滌切片 5 分鐘。
5. 用 100–400 µl 封閉液在室溫下封閉每個切片 1 小時。
6. 除去封閉液,并向每個切片中添加 100–400 µl 一抗稀釋液。 4°C 孵育過夜。
7. 去除抗體溶液,用洗滌緩沖液洗滌切片 3 次,每次 5 分鐘。
8. 用 1-3 滴所需的 HRPA 覆蓋切片。 在加濕室中室溫孵育 30 分鐘。
9. 用洗滌緩沖液洗滌切片 3 次,每次 5 分鐘。
10. 使用前將 DAB 顯色劑濃縮液加入 DAB 稀釋液中并充分混合。
11. 在每個切片上涂抹 100–400 µl DAB 并密切監(jiān)測。 1-10 分鐘通常可提供可接受的染色強度。
12. 將載玻片浸入 dH2O 中。
13. 如果需要,用蘇木精復染切片。
14. 用 dH2O 清洗切片兩次,每次 5 分鐘。
15. 切片脫水:95%乙醇孵育切片兩次,每次 10 秒; 在 100% 乙醇中重復,孵育切片兩次,每次 10 秒; 在二甲苯中重復,孵育切片兩次,每次 10 秒。
16. 用蓋玻片和封固劑封固切片。
|
| IF |
|---|
實驗步驟:
樣品準備
1. 貼壁細胞:取潔凈無菌蓋玻片置于培養(yǎng)皿中,待細胞接近長成單層后取出蓋玻片。
2. 懸浮細胞:將細胞接種至多聚賴氨酸包被的潔凈無菌載玻片上。
3. 冰凍切片:將玻片置于室溫下解凍,純水或 PBS 搖洗 3次,每次 3 min。
4. 石蠟切片:先將玻片脫蠟至水,純水或 PBS 搖洗 3次,每次 3 min。然后進行抗原修復。
固定
1. 使用固定液,如4%多聚甲醛(4% PFA)室溫固定細胞爬片/涂片或組織切片 10~15 min。
2. 使用 PBS 搖洗樣品 3次,每次 3 min。
通透
1. 對樣品添加去垢劑,如 0.1~0.3% Triton X-100,室溫通透 10~20 min。
(僅針對胞內抗原,若是細胞膜上表達的抗原則可省略該步驟。)
2. 使用 PBS 搖洗樣品 3次,每次 3 min。
封閉
添加封閉液,在室溫下封閉至少 1 h。(常用的封閉液包括:與二抗同一來源的血清、BSA或山羊血清。)
注意事項:從封閉開始之后的所有步驟務必保證樣品濕潤,避免干燥,否則極易產生高背景。
免疫熒光染色(第一天)
1. 吸走封閉液,滴加稀釋后的一抗。
2. 濕盒中 4°C 孵育過夜。
免疫熒光染色(第二天)
1. 吸走一抗,PBST 搖洗 3 次,每次 5 min。
2. 滴加稀釋后的熒光二抗,避光 4°C 孵育 1~2 h。
3. 吸走二抗,PBST 搖洗 3 次,每次 5 min。
4. 滴加稀釋后的 DAPI,室溫避光 孵育 5~10 min。
5. PBST 中搖洗 3 次,每次 5 分鐘。
封片
1. 抗熒光淬滅封片劑封片。
2. 干燥玻片,將玻片置于室溫下避光過夜。
3. 將載玻片放入玻片盒中 4°C 避光保存。
|
生物描述
| 特異性 |
|---|
GAD67/GAD1 Antibody [H1N10] 檢測內源性 GAD67 總的蛋白水平。 |
| 蛋白定位 |
|---|
| 細胞膜,細胞質,內膜,突觸 |
| Uniprot ID |
|---|
| Q99259 |
| 克隆號 |
|---|
| H1N10 |
| 別名 |
|---|
| GAD1,GAD67 |
| 背景 |
|---|
γ-氨基丁酸 (GABA) 是中樞神經系統(tǒng)中的主要抑制性神經遞質,對于調控神經元興奮性和維持大腦中興奮性和抑制信號之間的平衡至關重要。GABA 的合成由谷氨酸脫羧酶 (GAD) 催化,該酶有兩種亞型:GAD65 和 GAD67。GAD67 主要在神經元的細胞質中表達,尤其是在皮質、海馬和基底神經節(jié)等區(qū)域。它在 GABA 的基礎、連續(xù)產生中起著至關重要的作用,維持穩(wěn)定的抑制性神經傳遞,這對于學習、記憶和運動控制等認知功能至關重要。相反,GAD65 位于突觸小泡中,負責響應增加的神經元活動而快速、短暫地釋放 GABA。 GAD67 的正常功能對于調控突觸可塑性、神經元同步性和整體大腦穩(wěn)定性至關重要。GAD67 表達或活性功能障礙會導致神經精神疾病,包括精神分裂癥、癲癇和焦慮癥。 |
| 參考文獻 |
|---|
|
技術支持
在訂購、運輸、儲存和使用我們的產品的任何階段,您遇到的任何問題,均可以通過撥打我們的熱線電話400-668-6834,或者技術支持郵箱[email protected],直接聯(lián)系到我們。我們會在24小時內盡快聯(lián)系您。
* 必填項