- 抑制劑
- 研究領(lǐng)域
- PI3K/Akt/mTOR信號(hào)通路
- 表觀遺傳
- 甲基化
- 免疫&炎癥
- 酪氨酸蛋白激酶
- 血管生成
- 凋亡
- 自噬
- 內(nèi)質(zhì)網(wǎng)應(yīng)激&UPR響應(yīng)
- JAK/STAT信號(hào)通路
- MAPK信號(hào)通路
- 細(xì)胞骨架
- 細(xì)胞周期
- TGF-beta/Smad信號(hào)通路
- DNA損傷/DNA修復(fù)
- 化合物庫(kù)
- 抗體
- 生物試劑
- qPCR
- 2x SYBR Green qPCR Master Mix
- 2x SYBR Green qPCR Master Mix(Low ROX)
- 2x SYBR Green qPCR Master Mix(High ROX)
- 蛋白實(shí)驗(yàn)
- Protein A/G免疫沉淀磁珠
- Anti-DYKDDDDK Tag免疫磁珠
- Anti-DYKDDDDK Tag親和凝膠
- Anti-Myc免疫磁珠
- Anti-HA免疫磁珠
- 磁力架
- Poly DYKDDDDK Tag多肽
- 細(xì)胞核與細(xì)胞漿蛋白抽提試劑盒
- 免疫磁珠
- 蛋白酶抑制劑Cocktail
- 蛋白酶抑制劑Cocktail(DMSO儲(chǔ)液)
- 磷酸酶抑制劑Cocktail
- 細(xì)胞實(shí)驗(yàn)
- Cell Counting Kit-8 (CCK-8)
- 動(dòng)物實(shí)驗(yàn)
- 鼠尾直接PCR試劑盒(快速基因型鑒定)
- 小鼠CD3+ T細(xì)胞分選試劑盒
- 小鼠CD4+ T細(xì)胞分選試劑盒
- 小鼠CD8+ T細(xì)胞分選試劑盒
- 新產(chǎn)品
- 聯(lián)系我們
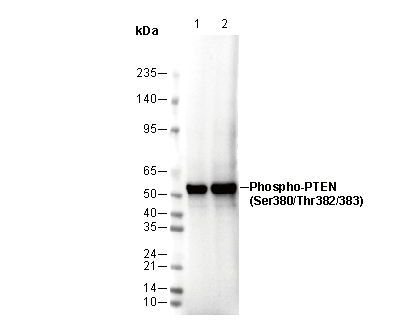
Phospho-PTEN (Ser380/Thr382/383) Antibody [K19C17]
目錄號(hào): F0499
客戶使用該產(chǎn)品的實(shí)驗(yàn)數(shù)據(jù)
使用信息
| 稀釋比例 |
|---|
|
| 抗體應(yīng)用 |
|---|
| WB |
| 反應(yīng)性 |
|---|
| Human, Mouse, Rat, Monkey |
| 抗體類(lèi)型 |
|---|
| Rabbit Monoclonal Antibody |
| 儲(chǔ)存液配方 |
|---|
| PBS, pH 7.2+50% Glycerol+0.05% BSA+0.01% NaN? |
| 儲(chǔ)存條件(自收到貨起) |
|---|
| –20°C (avoid freeze-thaw cycles), 2 years |
|
預(yù)測(cè)分子量
|
|---|
|
54 kDa
|
| 陽(yáng)性對(duì)照 | HeLa; NIH/3T3 |
|---|---|
| 陰性對(duì)照 |
實(shí)驗(yàn)方法
| WB |
|---|
實(shí)驗(yàn)步驟: 樣品制備
1. 組織樣品:破碎組織,加入適量冰冷的 RIPA/NP-40 Lysis Buffer (含蛋白酶抑制劑Cocktail, 磷酸酶抑制劑Cocktail),低溫勻漿或置于冰上超聲裂解樣品,靜置30 min。 2. 貼壁細(xì)胞樣品:吸去培養(yǎng)基, 將細(xì)胞轉(zhuǎn)移至EP管中。用冰冷的 PBS 清洗細(xì)胞 2 遍。加入適量冰冷的 RIPA/NP-40 Lysis Buffer (含蛋白酶抑制劑Cocktail, 磷酸酶抑制劑Cocktail),超聲破碎,冰上靜置裂解 30 min。冰上靜置裂解 5 min。 3. 懸浮細(xì)胞樣品:將培養(yǎng)基轉(zhuǎn)移至離心管中離心,棄上清,用冰冷的 PBS 清洗細(xì)胞 2 遍。加入適量冰冷的 RIPA/NP-40 Lysis Buffer (含蛋白酶抑制劑Cocktail, 磷酸酶抑制劑Cocktail),冰上靜置裂解 5 min。 4. 將所得勻漿液/裂解液置于離心機(jī)中 4°C 離心 15 min,收集上清液;
5. 取少量裂解液測(cè)定蛋白質(zhì)濃度;
6. 加入蛋白上樣緩沖液,將 20 µL樣品在 95~100°C加熱 5 min,冰上靜置冷卻后離心 5 min。
電泳分離
1. 根據(jù)所提蛋白的濃度,將適量蛋白樣品和 Marker 上樣至 SDS-PAGE 凝膠。建議分離膠(即下層膠)濃度:10 %。 SDS-PAGE 分離膠濃度選擇參照表 2. 電源調(diào) 80 V, 30 min。然后電源調(diào) 110 V~150 V,觀察 Marker,待蛋白所在的預(yù)染蛋白 Marker 指示帶得到合適的分離后,即可停止電泳。(注意電泳時(shí)電流切勿過(guò)大,如超過(guò) 150 mA 會(huì)導(dǎo)致溫度上升,容易影響跑膠結(jié)果。如無(wú)法避免采用大電流,可對(duì)電泳槽使用冰浴降溫。)
轉(zhuǎn)膜
1.拿出電轉(zhuǎn)槽,把夾子和耗材浸泡在預(yù)冷電轉(zhuǎn)液中;
2.用甲醇活化 PVDF 膜 1 min,用轉(zhuǎn)移緩沖液沖洗;
3.按照“夾子黑邊-海綿-濾紙-濾紙-膠-PVDF膜-濾紙-濾紙-海綿-夾子白邊”的順序安裝好; 4.將蛋白電轉(zhuǎn)移至 PVDF膜上。(推薦采用 0.45 µm PVDF 膜) PVDF 膜孔徑規(guī)格選擇參照表 濕轉(zhuǎn)法參考條件:200 mA, 120 min。
(注意電轉(zhuǎn)條件可根據(jù)蛋白大小適當(dāng)調(diào)節(jié),分子量大的蛋白適宜采用大電流,并延長(zhǎng)轉(zhuǎn)膜時(shí)間,但需要確保電轉(zhuǎn)槽始終處于低溫的環(huán)境中,避免凝膠融化。)
封閉
1. 電轉(zhuǎn)移后,室溫下用 TBST 洗膜 5 min;
2. 在封閉液(建議使用 5% BSA溶液)中將膜孵育 1 h,室溫;
3. 用 TBST 洗膜 3 次,每次 5 min。
抗體孵育 1. 用 一抗稀釋液配制一抗工作液(建議一抗稀釋比 1:1000),4°C 條件下與膜輕柔搖晃孵育過(guò)夜; 2. 用 TBST 洗膜 3 次,每次 5 min;
3. 在封閉液中加入二抗,室溫條件下與膜輕柔搖晃孵育 1 h;
4. 孵育結(jié)束后,用 TBST 洗膜 3 次,每次 5 min。
顯色
1. 加入配制好的 ECL 發(fā)光底物(或根據(jù)二抗選擇其他顯色基質(zhì))混合均勻;
2. 與膜孵育1 min,去除多余底物(需保持膜濕潤(rùn)),置于顯影儀中進(jìn)行曝光。
|
| IF |
|---|
實(shí)驗(yàn)步驟:
樣品準(zhǔn)備
1. 貼壁細(xì)胞:取潔凈無(wú)菌蓋玻片置于培養(yǎng)皿中,待細(xì)胞接近長(zhǎng)成單層后取出蓋玻片。
2. 懸浮細(xì)胞:將細(xì)胞接種至多聚賴氨酸包被的潔凈無(wú)菌載玻片上。
3. 冰凍切片:將玻片置于室溫下解凍,純水或 PBS 搖洗 3次,每次 3 min。
4. 石蠟切片:先將玻片脫蠟至水,純水或 PBS 搖洗 3次,每次 3 min。然后進(jìn)行抗原修復(fù)。
固定
1. 使用固定液,如4%多聚甲醛(4% PFA)室溫固定細(xì)胞爬片/涂片或組織切片 10~15 min。
2. 使用 PBS 搖洗樣品 3次,每次 3 min。
通透
1. 對(duì)樣品添加去垢劑,如 0.1~0.3% Triton X-100,室溫通透 10~20 min。
(僅針對(duì)胞內(nèi)抗原,若是細(xì)胞膜上表達(dá)的抗原則可省略該步驟。)
2. 使用 PBS 搖洗樣品 3次,每次 3 min。
封閉
添加封閉液,在室溫下封閉至少 1 h。(常用的封閉液包括:與二抗同一來(lái)源的血清、BSA或山羊血清。)
注意事項(xiàng):從封閉開(kāi)始之后的所有步驟務(wù)必保證樣品濕潤(rùn),避免干燥,否則極易產(chǎn)生高背景。
免疫熒光染色(第一天)
1. 吸走封閉液,滴加稀釋后的一抗。
2. 濕盒中 4°C 孵育過(guò)夜。
免疫熒光染色(第二天)
1. 吸走一抗,PBST 搖洗 3 次,每次 5 min。
2. 滴加稀釋后的熒光二抗,避光 4°C 孵育 1~2 h。
3. 吸走二抗,PBST 搖洗 3 次,每次 5 min。
4. 滴加稀釋后的 DAPI,室溫避光 孵育 5~10 min。
5. PBST 中搖洗 3 次,每次 5 分鐘。
封片
1. 抗熒光淬滅封片劑封片。
2. 干燥玻片,將玻片置于室溫下避光過(guò)夜。
3. 將載玻片放入玻片盒中 4°C 避光保存。
|
| IHC |
|---|
實(shí)驗(yàn)步驟:
脫蠟/補(bǔ)液
1. 脫蠟/水合切片:
2. 將切片在二甲苯中孵育 3 次,每次 5 分鐘。
3. 將切片在 100% 乙醇中孵育兩次,每次 10 分鐘。
4. 將切片在 95% 乙醇洗滌液中孵育兩次,每次 10 分鐘。
5. 用 dH2O 清洗切片兩次,每次 5 分鐘。
6.抗原修復(fù):對(duì)于檸檬酸鹽:將載玻片浸入 1X 檸檬酸鹽暴露溶液中,在微波爐中加熱,直至開(kāi)始沸騰; 在亞沸溫度 (95°-98°C) 下繼續(xù)煮 10 分鐘。 在工作臺(tái)上冷卻玻片 30 分鐘。
染色
1. 用 dH2O 清洗切片 3 次,每次 5 分鐘。
2. 將切片在 3% 過(guò)氧化氫中孵育 10 分鐘。
3. 用 dH2O 清洗切片兩次,每次 5 分鐘。
4. 在洗滌緩沖液中洗滌切片 5 分鐘。
5. 用 100–400 µl 封閉液在室溫下封閉每個(gè)切片 1 小時(shí)。
6. 除去封閉液,并向每個(gè)切片中添加 100–400 µl 一抗稀釋液。 4°C 孵育過(guò)夜。
7. 去除抗體溶液,用洗滌緩沖液洗滌切片 3 次,每次 5 分鐘。
8. 用 1-3 滴所需的 HRPA 覆蓋切片。 在加濕室中室溫孵育 30 分鐘。
9. 用洗滌緩沖液洗滌切片 3 次,每次 5 分鐘。
10. 使用前將 DAB 顯色劑濃縮液加入 DAB 稀釋液中并充分混合。
11. 在每個(gè)切片上涂抹 100–400 µl DAB 并密切監(jiān)測(cè)。 1-10 分鐘通常可提供可接受的染色強(qiáng)度。
12. 將載玻片浸入 dH2O 中。
13. 如果需要,用蘇木精復(fù)染切片。
14. 用 dH2O 清洗切片兩次,每次 5 分鐘。
15. 切片脫水:95%乙醇孵育切片兩次,每次 10 秒; 在 100% 乙醇中重復(fù),孵育切片兩次,每次 10 秒; 在二甲苯中重復(fù),孵育切片兩次,每次 10 秒。
16. 用蓋玻片和封固劑封固切片。
|
生物描述
| 特異性 |
|---|
Phospho-PTEN (Ser380/Thr382/383) Antibody [K19C17] 可檢測(cè) Ser380、Thr382 和 Thr383 處磷酸化的 PTEN 的內(nèi)源水平。 它還可能與 Ser380 單磷酸化的 PTEN 反應(yīng)。 該抗體還可以檢測(cè) 70 kD 的變體(PTEN-long/PTENα 和 PTENβ)。 |
| 蛋白定位 |
|---|
| 細(xì)胞突起,細(xì)胞質(zhì),細(xì)胞核,細(xì)胞外基質(zhì),突觸 |
| Uniprot ID |
|---|
| P60484 |
| 克隆號(hào) |
|---|
| K19C17 |
| 別名 |
|---|
| Phospho-PTEN (Ser380),Phospho-PTEN (Ser380/Thr382/383),PTEN (phospho S380) |
| 背景 |
|---|
PTEN 是癌癥中最常見(jiàn)的失活腫瘤抑制基因之一。 在多種人類(lèi)癌癥中,經(jīng)常觀察到 PTEN 基因或蛋白質(zhì)水平的改變或缺陷。 此外,源于種系 PTEN 突變的遺傳綜合征會(huì)增加腫瘤發(fā)生的風(fēng)險(xiǎn)。 PTEN 通過(guò)多種機(jī)制發(fā)揮其腫瘤抑制作用,包括磷酸酶依賴性和獨(dú)立活性、亞細(xì)胞定位和蛋白質(zhì)相互作用。 這些作用影響多種細(xì)胞功能,包括生長(zhǎng)、增殖、存活、DNA 修復(fù)和細(xì)胞運(yùn)動(dòng)。 值得注意的是,PTEN 的磷酸酶活性主要針對(duì)癌癥中最重要的信號(hào)通路之一:PI3K/AKT/mTOR,它對(duì)于細(xì)胞生長(zhǎng)和促生存功能至關(guān)重要。 |
| 參考文獻(xiàn) |
|---|
|
技術(shù)支持
在訂購(gòu)、運(yùn)輸、儲(chǔ)存和使用我們的產(chǎn)品的任何階段,您遇到的任何問(wèn)題,均可以通過(guò)撥打我們的熱線電話400-668-6834,或者技術(shù)支持郵箱[email protected],直接聯(lián)系到我們。我們會(huì)在24小時(shí)內(nèi)盡快聯(lián)系您。
* 必填項(xiàng)